第3章 水産物の安全・安心のための取組
水産技術研究所 環境・応用部門長
鈴木 敏之
はじめに
水産研究・教育機構(以下、機構)では、設立以来、水産物の利用加工研究の一環として、水産物の安全・安心に関する研究に取り組んできました。記録に残る研究として、昭和17年(1942年)に浜名湖のアサリにより100名以上の死者を出した中毒原因物質の解明があげられますが、原因物質の解明には至りませんでした。また、昭和35年(1960年)代には、石川県などの伝統食品であるフグ卵巣糠漬けにおけるフグ毒テトロドトキシンの減毒メカニズムの解明に取り組んだ研究を行いました。このように機構では、設立以来、水産物の安全・安心に関する研究に取り組んできましたが、平成4年(1992年)に機構の前身の一つである水産庁東北区水産研究所に、麻痺性貝毒や下痢性貝毒など貝毒に関する研究を柱とした増殖漁場研究室が設置されたことが発端となり、本格的に水産物の安全・安心に関する研究が始まっています。本稿では、水産研究125周年に際し、機構が取り組んできた貝毒研究のトピックを紹介いたします。
CODEXの「活及び生鮮二枚貝の規格(CODEX STAN 292-2008)」では、化学構造に基づいて5つの貝毒グループに分類しています。即ち、麻痺性貝毒サキシトキシン(saxitoxin; STX)群、下痢性貝毒オカダ酸(okadaic acid; OA)群、記憶喪失性貝毒ドウモイ酸(domoic acid; DA)、神経性貝毒ブレベトキシン(brevetoxin; BTX)群、アザスピロ酸(azaspiracid; AZA)群です。これら5つの貝毒グループの中で、わが国で問題となっている貝毒は麻痺性貝毒と下痢性貝毒です。この2つの貝毒は、世界的にも最も重要な海産食品のリスクとして知られています。そのため、機構では、麻痺性貝毒と下痢性貝毒について重点的に研究を行ってまいりました。
貝毒の監視体制
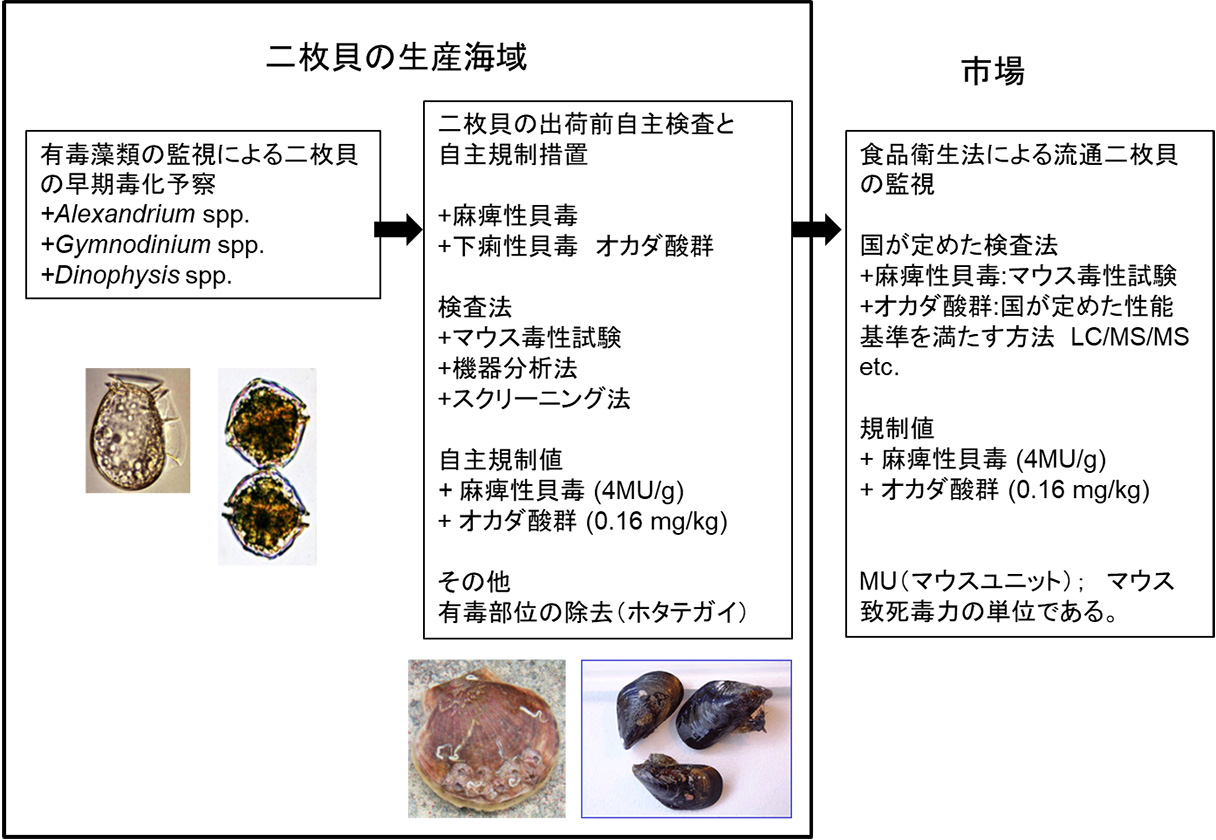
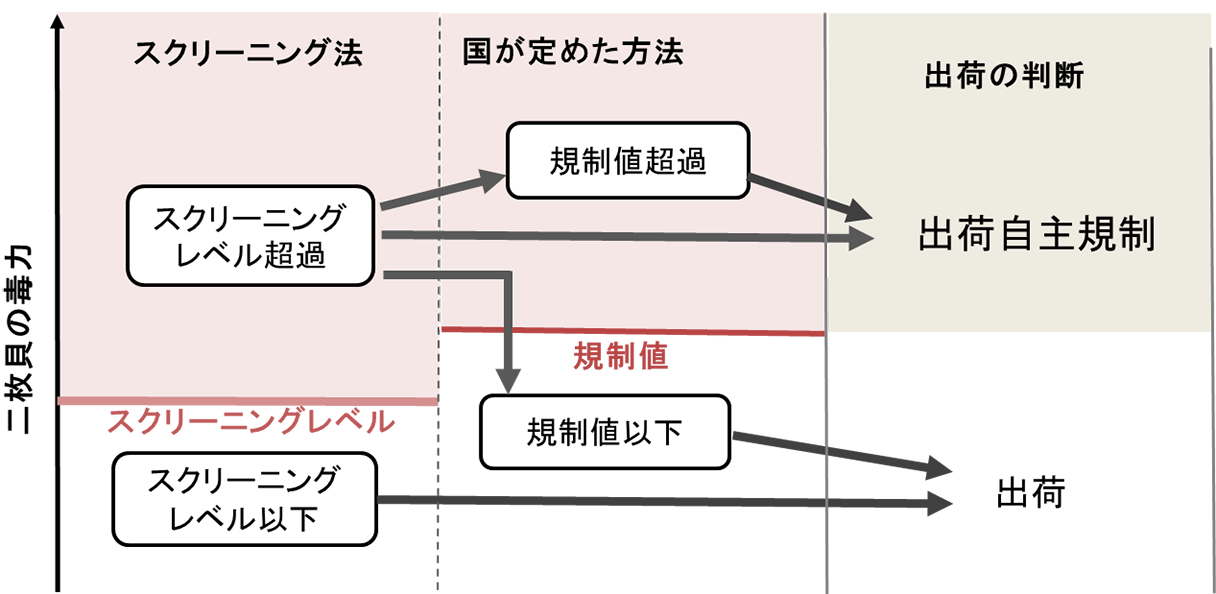
機構が取り組んできた貝毒研究の背景として、貝毒の監視体制について概要を説明いたします。わが国では、貝毒による食中毒を防ぐために、二枚貝生産海域から流通に至る段階的な監視体制が整備されています(図1)。生産海域においては、有毒藻類や二枚貝の毒力を監視するために監視定点を定めています。有毒藻類の監視は、都道府県の水産関係試験研究機関により行われています。有毒藻類の監視は、生産海域における二枚貝の毒化を事前に予察し、二枚貝の監視を強化する上で重要な情報となっており、有毒藻類の出現情報は、水産サイドの試験研究機関や行政部局により公表され、二枚貝生産者に直接伝えられることもあります。通常、有毒藻類の発生、出現密度の上昇により、二枚貝の貝毒検査は最低、週1回の頻度で行われるようになります。貝毒検査により、国が定める規制値を超える毒力が検出された二枚貝については、生産者による出荷自主規制措置が講じられます。自治体によっては、規制値よりも低い値で自主規制措置を要請している二枚貝種もあります。原則として、3週連続で規制値を下回った場合に限り、二枚貝の出荷が再開されますが、毒が速やかに排泄される二枚貝種については、科学的知見が得られれば自主規制期間を短縮することも可能です。また、ホタテガイ等の一部の二枚貝については、有毒部位の除去等の処理を適切に行うことにより、出荷が認められています。市場に流通した二枚貝については、食品衛生法の下で公定法や国が通知した性能基準を満たす検査法による監視が行われています。こうした監視体制の整備により、わが国では近年、市場に流通した二枚貝による食中毒事例は報告されていません。
下痢性・脂溶性貝毒機器分析法の開発
下痢性貝毒や麻痺性貝毒など多くの海洋生物毒は、有毒藻類により産生されます。有毒藻類により産生される毒は、単一成分ではなく、化学構造が異なる複数の類縁体により構成されます。さらに、毒が食物連鎖を介して魚介類に取り込まれた後、毒を蓄積した魚介類の代謝により、毒の化学構造が修飾され変化するため、魚介類が有する毒の組成は極めて複雑になります。こうした魚介類が有する毒組成の複雑さ故に、全ての毒を機器分析法などで測定することは技術的に極めて困難でした。そのため、過去数十年間にわたり、麻痺性貝毒や下痢性貝毒検査は、マウスを用いた動物検査法が世界的に公定法として利用されてきました。動物検査法は魚介類に含まれている毒の種類については、正確に同定できませんが、動物の生死で毒力を判定するため、わかりやすい検査法です。しかし、動物検査法は、多数の動物の命を犠牲に検査を実施するという倫理的な問題があり、さらに、下痢性貝毒では、遊離脂肪酸による偽陽性反応など検査法の精度や選択性に係る問題点が指摘されてきました。そのため、動物検査法に代わる高精度かつ高感度で選択的な分析法の開発は、世界的に重要な課題となっていました。
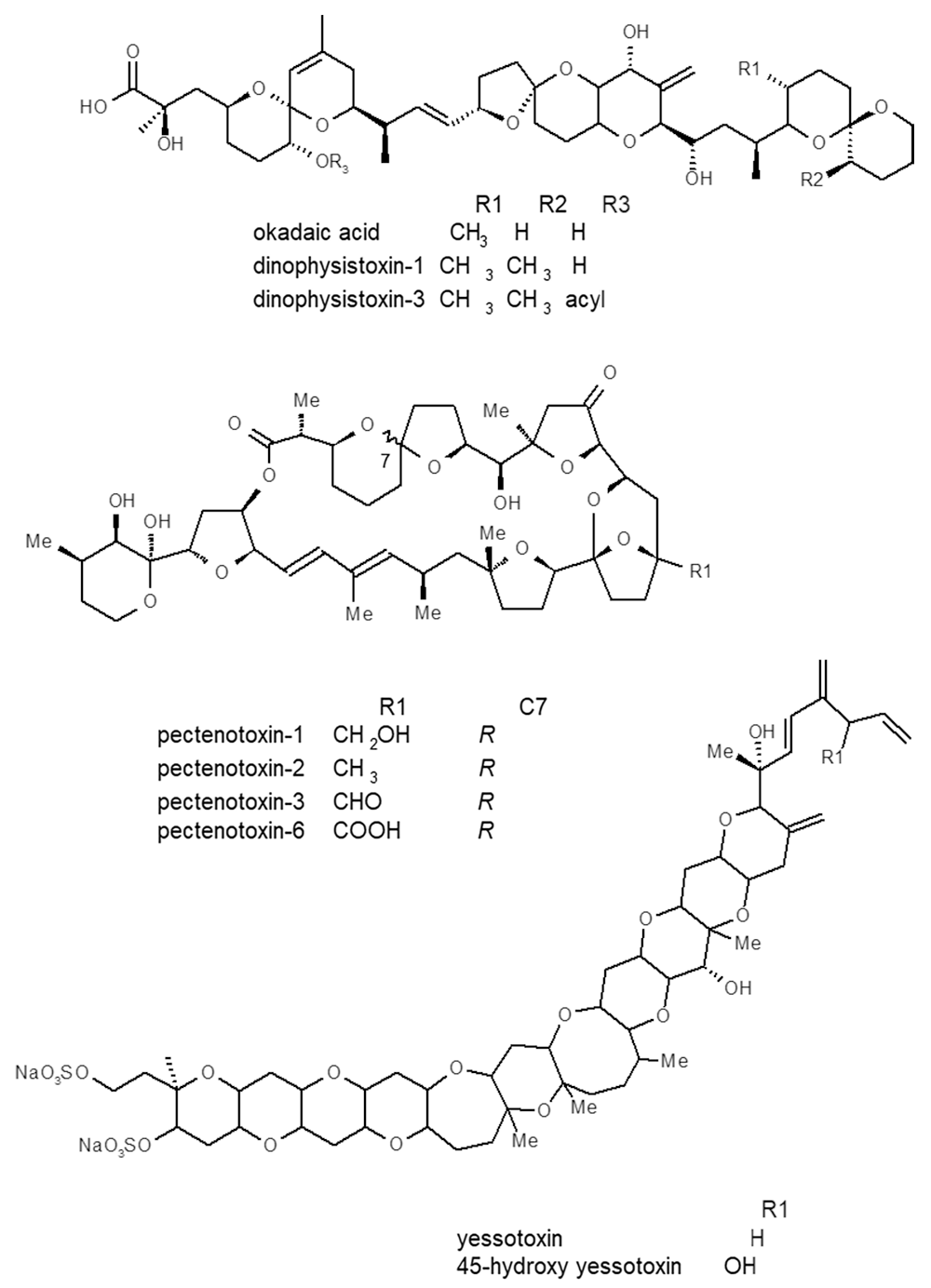
下痢性貝毒は、化学構造の違いにより、オカダ酸群(okadaic acid; OA)、ペクテノトキシン群(pectenotoxin; PTX)、イェッソトキシン(yessotoxin; YTX)群の3群に分類されてきました(図2)。近年、オカダ酸群は下痢性貝毒、ペクテノトキシン群とイェッソトキシン群は脂溶性貝毒と呼ばれ、区別されています。これらの毒群は全て動物検査法で強い毒力を示し、東北大学の安元教授らのグループにより動物検査法を指標に毒が単離され、化学構造が決定されました1)。わが国の天然物化学そして水産化学研究の金字塔の一つと言えます。近年、液体クロマトグラフィー(LC)用に多種多様な担体が開発され、質量分析装置(MS)が高性能化されたことにより、かつては困難であった様々な化合物の一斉分析が液体クロマトグラフィー/質量分析法(LC/MS)により可能になりました。機構は、ニュージーランドやカナダの研究機関などとの国際的な共同研究や連携により、下痢性貝毒や脂溶性貝毒の機器分析法の研究を先導してきました2)。現在、わが国を含めて多くの国々で下痢性貝毒の公定法となっている機器分析法(LC/MS/MS)の基礎的な分析条件は、こうした研究の中で確立されたものです。さらに、LC/MS/MSにより、極めて複雑な化学構造を有する下痢性貝毒や脂溶性貝毒の化学構造の解析を容易に行うことができるようになりました。機器分析法の開発により、これまで明らかにされてこなかった二枚貝の詳細な下痢性貝毒組成が初めて明らかになり、新規類縁体なども多数発見されました。図3は、国内産二枚貝の下痢性貝毒組成です。下痢性貝毒と一言で片付けるには極めて複雑な毒組成であることがわかります。
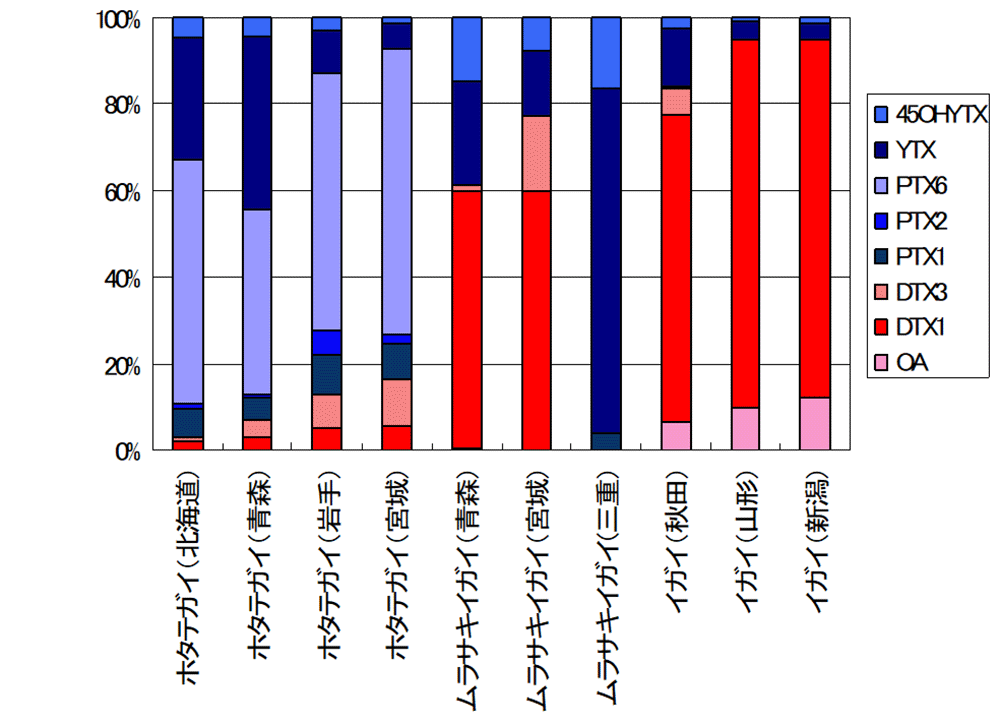
毒組成は同一海域で採捕した多数ロットの平均値として示した。赤系統の色は下痢原性がある毒。青系統の色は下痢原性はないがマウス腹腔内投与で陽性を示す毒。
オカダサン群;OA, DTX1, DTX3
ぺクテノトキシン群;PTX1, PTX2, PTX6
イエッソトキシン群;YTX, 45HYTX
わが国のホタテガイの特異な毒組成と下痢性貝毒規制の改正
下痢性貝毒の検査法に機器分析法を導入することにより、動物検査法では区別ができない下痢性貝毒3群を正確に測定することが可能になります。化学構造が異なる3群の毒群はそれぞれ毒としての作用機序が異なり、ヒトに対するリスクも異なります。そのため、機器分析法の導入に際して、規制対象とする毒の検討は極めて重要な課題でした。機構では、レギュラトリーサイエンスの考え方に基づき、様々な科学的なデータを蓄積しました。レギュラトリーサイエンスとは、「科学技術の成果を人と社会に役立てることを目的に、根拠に基づく的確な予測、評価、判断を行い、科学技術の成果を人と社会との調和の上で最も望ましい姿に調整するための科学」(第4次科学技術基本計画 平成23年8月19日)と定められています。下痢性貝毒機器分析法の導入とそれに伴う新たな貝毒規制体制の改正においては、ヒトに対するリスク評価に加えて、二枚貝産業に及ぼす影響についても検討する必要がありました。ホタテガイは、言うまでもなく、わが国の二枚貝養殖業においてマガキと並ぶ産業重要種です。下痢性貝毒原因藻類の出現により、二枚貝が毒化するのは初夏になります。マガキの旬は冬であることから、マガキにおいては下痢性貝毒が問題になることはほとんどありません。こうしたことから、下痢性貝毒の機器分析法の導入と規制体制の改正は、わが国の最重要水産物の一つであるホタテガイにおいて特に影響が大きくなります。旧公定法である動物検査法において検出される毒成分は、前述したとおり、オカダ酸群、ぺクテクノトキシン群、イェッソトキシン群です。CODEX国際規格では、ペクテノトキシン群やイェッソトキシン群に対しては、ヒトに対する健康被害が報告されておらず、リスクが不明であることなどから、規制値を設けておらず、規制対象外の扱いでした。一方、欧州連合(European Union; EU)では、これら2群に対しても規制値を設けており、ホタテガイをEUに輸出しているわが国としては、CODEX国際規格を採用し、ペクテノトキシン群やイェッソトキシン群を規制対象外とするか、EU型の規制体制に準じた3群を規制する体制を整備するかについては、重要な検討課題でありました。そこで鍵となったのがわが国のホタテガイ(Mizuhopecten yessoensis)が有する極めて特異的な毒組成です。
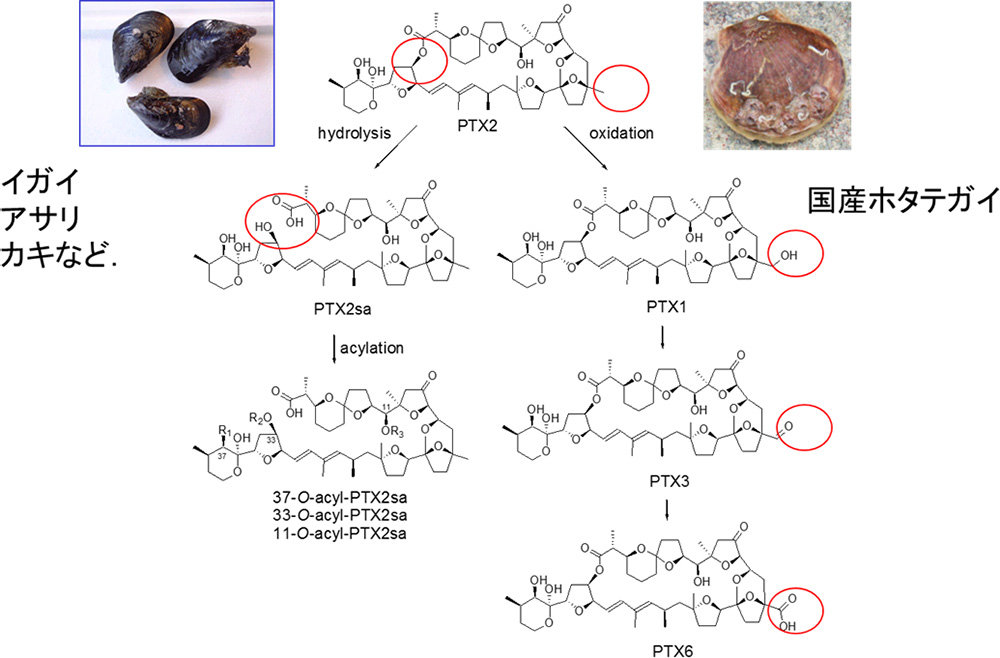
ホタテガイの主要毒は、図3で示したように産地によらずペクテノトキシン6とイェッソトキシンです。有毒藻類Dinophysis属は、オカダ酸群に加えてペクテノトキシン2を産生します。ホタテガイはペクテノトキシン2をペクテノトキシン1へと変換し、最終代謝物と推察されるペクテノトキシン6を蓄積します3)(図4)。一方、ホタテガイ以外のほとんどの二枚貝では、ペクテノトキシン2は環状構造が開環したペクテノトキシン2セコ酸(PTX2sa)に速やかに代謝されます4)(図4)。さらに、ペクテノトキシン2セコ酸は公定法の動物試験では無毒です。したがって、カキやイガイ類でペクテノトキシン群が規制上、問題になることは実質的にありません。一方、わが国のホタテガイは、マウス毒性があるペクテノトキシン6を主要成分として蓄積するという点において、世界的にも類がない固有種と言えます。そこで、機構では、千葉大学との共同研究により、ペクテノトキシン6を毒化したホタテガイから大量に単離し、高純度の毒を用いた動物実験による毒性評価を実施しました。その結果、ペクテノトキシン6には経口投与による下痢原性がないことが明らかになりました5)。さらに、この研究ではオカダ酸群とペクテノトキシン6を同時にマウスに経口投与した場合に、ペクテノトキシン6にはオカダ酸群の毒性を相乗的に増加させる作用もないことを明らかにしました。機構では、ペクテノトキシン6のin vitroでの細胞毒性についても検証し、ペクテノトキシン2とは異なり、毒性がないことを確認しています6)。一方、10年以上にわたり青森県と連携し、機器分析法の導入を前提に、モニタリング定点で採捕されるホタテガイを対象に、旧公定法であるマウス毒性試験と機器分析法(LC/MS法)による検査結果に係るデータを蓄積し、将来の規制の在り方について検証してきました7)。その結果、EU規制値に基づきペクテノトキシン群を規制対象として機器分析法を導入すると、規制件数が極端に増加し、ホタテガイ養殖に壊滅的な影響を及ぼすことが明らかでした。一方、CODEX国際規格に基づきオカダ酸群のみを規制した場合には、規制件数が大幅に少なくなることも明らかになりました。こうした研究データの蓄積により、わが国としてはEU型の規制体制ではなく、CODEX国際規格に基づく規制体制に移行することを選択し、厚生労働省の薬事・食品衛生審議会や内閣府食品安全委員会で議論を重ねた結果、現在の機器分析法に基づく新たな貝毒検査体制への移行が実現しました。貝毒検査体制に機器分析法が導入され、オカダ酸群のみを規制対象としたことにより、動物検査法とは比較にならないほど高精度かつ高感度に下痢原性のあるオカダ酸群を検出できるようになりました。さらに、規制対象毒を絞り込んだことにより、貝毒による出荷規制は大幅に減少し、青森県のホタテガイの販売額は一時期、200億円を突破しました。公定法に機器分析法が導入される以前の販売額と比較すると2倍を超える額であり、青森県のホタテガイ産業に大きな追い風となりました。漠然とした安全・安心のみを重視したEU型の規制体制を導入し、下痢性貝毒オカダ酸群に加えて、ペクテノトキシン群やイェッソトキシン群も加えた規制体制を構築していたら、ホタテガイ産業は全く異なる状況に直面していたと思われます。こうした研究成果により、平成28年(2016年)に青森県漁業者3団体(青森県漁業協同組合連合会、むつ湾漁業振興会、青森県ほたて流通振興協会)から機構に対して「感謝状」が贈られました。なお、昨年令和3年(2021年)、EUにおいてもペクテノトキシン群は規制対象から完全に除外されました。下痢性貝毒検査に機器分析法を導入した現在の監視体制は、消費者の安全と二枚貝産業の振興を両立させた好例であり、農林水産省等が進めているレギュラトリーサイエンス関連研究事業の成果と言えます。
下痢性貝毒認証標準物質
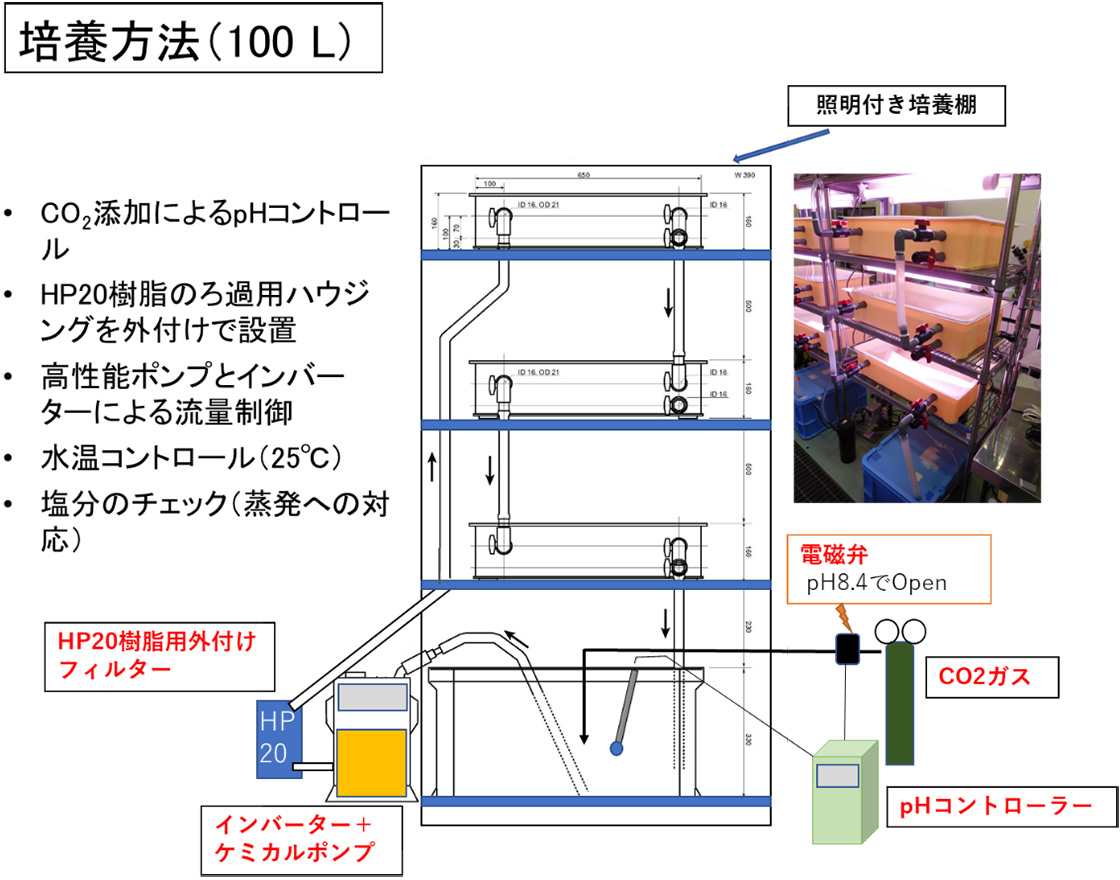
機器分析法による貝毒監視体制を維持するためには、機器分析法において必須となる貝毒標準物質を安定的に供給する必要があります。標準物質とは、純度が極めて高く、含量や濃度が既知の純品であり、機器分析法では、測定対象とする化合物の標準物質は不可欠です。将来、わが国のホタテガイの輸出拡大を検討する際、貝毒検査で使用する標準物質は、国際認証標準物質でなければなりません。国際認証標準物質とは、国際的に定められたプロセスや手法により、濃度が決定され、同時に不確かさが付与された標準物質であり、世界のどこでも利用することが認められている標準物質になります。また、わが国の国家標準物質としても無条件で利用できます。下痢性貝毒オカダ酸群の認証標準物質はカナダのNational Research Council(NRC)が製造しており、世界的に普及している国際認証標準物質です。需要が多く、供給量も限られるため、在庫は十分にあるとは言い難いところです。貝毒検査の標準物質を海外の製品にのみ依存することは、在庫切れに伴う貝毒検査の停滞などのリスクを勘案すると望ましいことではありません。わが国では、農林水産省の研究事業により、有毒藻類の大量培養(図5)による貝毒標準品の製造技術の開発が行われました8)。そのために、高知大学と連携し、国内沿岸の下痢性貝毒産生藻類(Prorocentrum lima)を1000株近く収集し、培養株を作製し、世界で最も毒産生能の高い株を発見しました。この株の大量培養と超臨界流体抽出法等を利用した毒の抽出・精製技術の高度化により、下痢性貝毒標準物質の原料となる精製毒を簡便かつ大量に製造できる技術を確立しました。また、貝毒標準物質の濃度決定のため核磁気共鳴装置(NMR)を用いた定量法の開発も行いました9)。こうした基礎技術の蓄積により、国立研究開発法人産業技術総合研究所と機構により、 下痢性貝毒オカダ酸群の国際認証標準物質が短期間のうちに開発されました。わが国初の貝毒の国際認証標準物質として注目されており、平成28年(2016年)4月から市販品が提供され、わが国の貝毒検査の要となっています(図6)。さらに、オカダ酸群を含むホタテガイの組成標準物質の開発も進められ、市販品が販売されています。ホタテガイ組成標準物質は、各検査機関の検査結果の妥当性等を検証するために必要であり、こうした標準物質の普及により、国内の貝毒検査の標準化が一層進むことになり、二枚貝の安全性はさらに向上することになりました。

(左)オカダ酸標準液,(右)ジノフィシストキシン1標準液
麻痺性貝毒標準物質
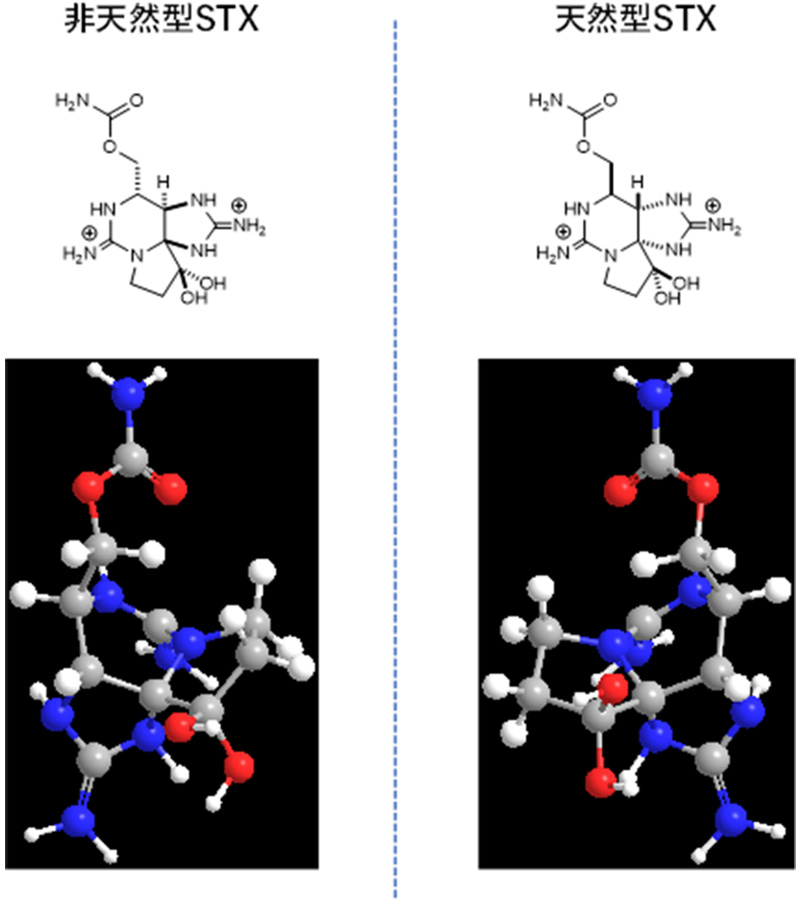
麻痺性貝毒については、現状において国内公定法はマウスを用いた動物検査法です。したがって、下痢性貝毒とは異なり、機器分析用の標準物質の国内需要は今のところありません。しかし、将来の機器分析法の導入に向けた研究や標準物質の開発が進められてきました。機構では、有毒ラン藻や有毒藻類を大量培養することにより得られる麻痺性貝毒C1、2やゴニオトキシン1、4(Gonyautoxin-1、4; GTX1、4)を原料として化学変換法を開発することにより、必要な標準物質を全て製造できる技術を確立しています8)。麻痺性貝毒機器分析法の導入において、最も大きな障害は分析用標準物質として不可欠なサキシトキシン(Saxitoxin; STX)です。サキシトキシンは化学兵器禁止条約に規定された物質であり、その使用や運搬・製造などが厳しく制限されています。欧州諸国も化学兵器禁止条約には批准していますが、域内の法令等によりサキシトキシンの使用が比較的容易であることから、貝毒検査の現場に機器分析法が導入されつつあります。一方、わが国では、サキシトキシンが上述した条約を背景とした国内法(化学兵器禁止法)により厳しく規制されているため、機器分析法の導入に際し大きな障壁となっています。こうした課題を解決するため、安全に使用できる代替サキシトキシン標準物質の開発が求められてきました。そこで、機構はサキシトキシンの鏡像異性体(図7)に着目しました。鏡像異性体は、鏡に映した鏡像のように対称な異性体で、沸点、融点などの物理化学的な特性は同一ですが、生物に対する作用が異なります。機構は、東京農工大学、東北大学との共同研究により、天然には存在しないサキシトキシン鏡像異性体の開発に成功し10)、その物理化学的性質が天然型サキシトキシンと同一であることを証明しました。また、サキシトキシン鏡像異性体は毒性を持たない物質であることを、細胞を用いた試験によって確認しました。この研究により、サキシトキシン鏡像異性体は、サキシトキシンの安全な代替標準物質として、機器分析法で利用できることが明らかになりました。毒性を有する化合物の機器分析法において、無毒の鏡像異性体が用いられた例は著者が知る限りなく、将来の毒物検査において先駆的な研究と言えます。現在、経済産業省では、サキシトキシン鏡像異性体の化学兵器禁止法における扱いについて検討を進めており、近い将来、サキシトキシン鏡像異性体が普及し、機器分析法への移行が進むことが期待されています。
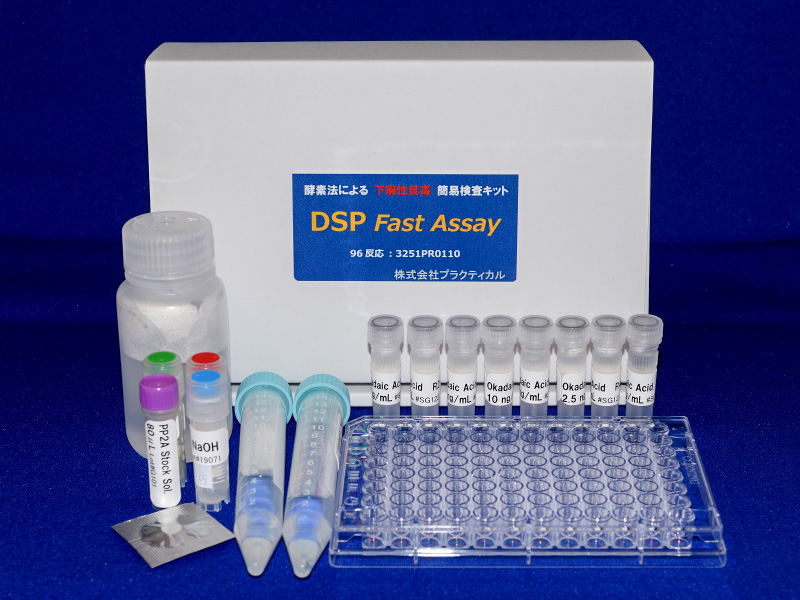
貝毒簡易検査キットの開発
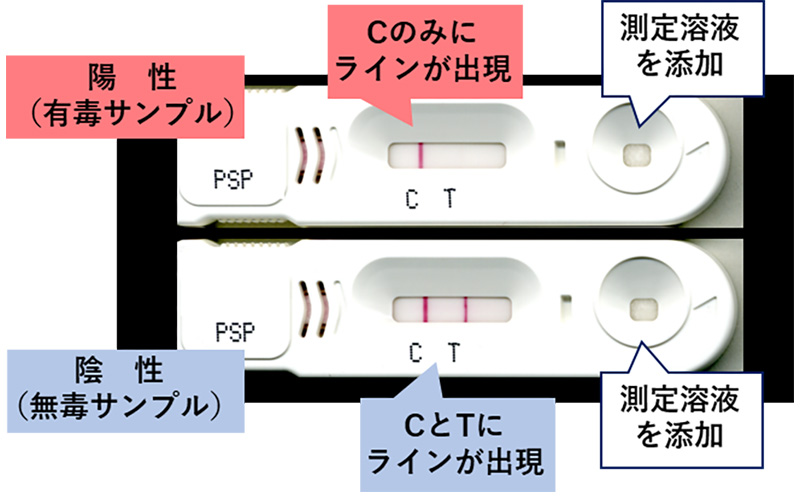
出荷前の自主検査については、農林水産省の通知により、以前は公定法による検査が必要でしたが、平成27年(2015年)以降、農林水産省の新ガイドライン「二枚貝等の貝毒リスク管理に関するガイドライン」が制定され、機器分析法や簡易測定法を含めた様々な手法を用いることが認められています。農林水産省の新ガイドラインに基づく貝毒検査で利用できる検査法は、国が定めた検査法とその他の検査法に大別することができます。国が定めた検査法は、食品衛生法の規制値への適合を判定する方法で、麻痺性貝毒公定法であるマウス毒性試験や下痢性貝毒では、厚生労働省が通知した性能基準を満たす検査法がこれに該当します。その他の方法は、スクリーニングなどの目的に利用できる方法です。図8に農林水産省の新ガイドラインに基づくスクリーニング法の運用例を示します。スクリーニング法とは、スクリーニング法により得られる測定結果がスクリーニングレベル以下であれば、常に規制値以下であることを科学的に証明できる手法です。機構では、貝毒のスクリーニング法として利用するために、貝毒簡易検査キットを民間企業と共同で開発して、市販品を発売しています(図9、10)。これらのキットは、一部の海域では実際の貝毒モニタリングに導入され活用されています。また、市販品を発売した後もキットの利用研修会や現地説明会を開催するなどの普及に向けた活動を続けています。キットの特性を理解して適切に利用することができれば、限られた予算で、迅速かつ、きめの細かい貝毒モニタリング体制を構築することが可能になります。また、機器分析法を確定検査法として定め、スクリーニング法を現場の貝毒モニタリングで利用することができれば、世界で最も進んだ貝毒監視体制を構築することも可能になります。
おわりに
本稿で取り上げた貝毒に関する研究成果は、分析化学、有機化学、藻類学、毒物学、病理学など多岐にわたる研究領域に及ぶ成果です。こうした領域において、機構のような公的研究機関が果たす役割は益々大きくなると思われます。その一方で、大学や民間企業を含む他分野間の連携も益々重要になります。水産研究は、総合力が試される研究領域であり、様々な専門分野が参加できる総合科学です。水産研究125年に際し、機構は今後も水産研究のイニシアティブをとり得る知性を磨き、学術的にレベルの高い研究を推進するとともに、実学として社会に役立つ研究に邁進いたします。
謝辞
本稿で紹介した研究成果の一部は、農林水産物安定供給のためのレギュラトリーサイエンス研究委託事業「麻痺性貝毒の機器分析法の高度化及びスクリーニング法の開発」、「安全で信頼性、機能性が高い食品・農産物供給のための評価・管理技術の開発(下痢性貝毒ペクテノトキシン6の精製と毒性評価)」、「農林水産省海洋生物毒安全対策事業」、 「レギュラトリーサイエンス新技術開発事業(有毒藻類の培養による各種貝毒標準品の製造技術の確立)」、 「戦略的イノベーション創造プログラム(未利用藻類の高度利用を基盤とする培養型次世代水産業の創出に向けた研究開発)」、農研機構生研支援センター「革新的技術開発・緊急展開事業(うち経営体強化プロジェクト)」により実施しました。また、青森県のホタテガイ関連データは、青森県水産総合研究センター増養殖研究所との共同研究により実施したものです。関係者の皆様に深くお礼申し上げます。
鈴木 敏之すずき としゆき
【略歴】 海洋生物毒研究者。2009年から厚生労働省 薬事・食品衛生審議会や内閣府 食品安全委員会の委員として、貝毒・フグ毒のリスク管理施策にも関与。中央水産研究所で室長、グループ長、部長を歴任し、2020年の組織改編後から水産技術研究所 環境応用・部門長。

引用文献